valencija (kasnolat. valentia: snaga; sposobnost), u kemiji, svojstvo atoma pojedinog elementa da se spaja s određenim brojem atoma nekoga drugog elementa u kemijski spoj. Atom koji se uvijek spaja samo s jednim atomom drugog elementa naziva se jednovalentnim, pa se i za element koji sadrži takve atome kaže da je jednovalentan. Takvi su elementi npr. vodik i klor, pa su se valencije ostalih elemenata definirale brojem atoma jednovalentnog elementa s kojim se spaja jedan atom tog elementa. Prema tomu bi u spojevima HF, H2O, BCl3 i SiCl4 fluor bio jednovalentan, kisik dvovalentan, bor trovalentan i silicij četverovalentan. Međutim, za većinu elemenata takva stehiometrijska valencija nije stalna veličina, nego ovisi o broju elektrona koje je atom elementa angažirao kako bi se povezao s drugim atomima. Tako je npr. dušik u dušikovu monoksidu (NO) dvovalentan, kao i kisik, a u dušikovu dioksidu (NO2) četverovalentan.
Umjesto pojma valencija, u suvremenoj se kemiji znatno više rabi pojam oksidacijskoga broja (oksidacijskoga stupnja). To je formalna veličina koja opisuje oksidacijsko stanje atoma, a definira se kao broj (elementarnih) naboja koji bi ostali na promatranom atomu ako bi se elektronski parovi svih veza u bilo kojoj kemijskoj jedinki pripisali najelektronegativnijem atomu, npr. 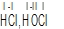 (→ elektronegativnost). Oksidacijski broj može biti pozitivan (predznak + se izostavlja), negativan i nula, a piše se iznad simbola atoma rimskim brojem. Pri imenovanju kemijskih spojeva oksidacijski se broj piše odmah iza naziva elementa, u okrugloj zagradi, npr. željezov(II) klorid za FeCl2. Ako element ima samo jedno oksidacijsko stanje, oksidacijski se broj u njegovim spojevima ne piše; takav je npr. aluminij, kojemu je oksidacijski broj uvijek III. Oksidacijski se broj određuje prema dogovorenim pravilima: 1) oksidacijski broj atoma ili molekule elementa u elementarnom stanju uvijek je jednak nuli; 2) oksidacijski broj vodika uvijek je I, osim u metalnim hidridima, u kojima je –I; 3) oksidacijski broj kisika uvijek je –II, osim u peroksidima, u kojima je –I, a samo je u spoju s fluorom I; 4) oksidacijski broj svih jednoatomnih iona (gradivne čestice ionskih spojeva) jednak je naboju iona, npr. oksidacijski broj kalcija u ionu Ca2+ je II, a klora u kloridnom ionu Cl– je –I; 5) zbroj oksidacijskih brojeva svih atoma u neutralnoj molekuli ili formulskoj jedinki mora biti jednak nuli; 6) zbroj oksidacijskih brojeva atoma u višeatomnim ionima mora biti jednak naboju iona
(→ elektronegativnost). Oksidacijski broj može biti pozitivan (predznak + se izostavlja), negativan i nula, a piše se iznad simbola atoma rimskim brojem. Pri imenovanju kemijskih spojeva oksidacijski se broj piše odmah iza naziva elementa, u okrugloj zagradi, npr. željezov(II) klorid za FeCl2. Ako element ima samo jedno oksidacijsko stanje, oksidacijski se broj u njegovim spojevima ne piše; takav je npr. aluminij, kojemu je oksidacijski broj uvijek III. Oksidacijski se broj određuje prema dogovorenim pravilima: 1) oksidacijski broj atoma ili molekule elementa u elementarnom stanju uvijek je jednak nuli; 2) oksidacijski broj vodika uvijek je I, osim u metalnim hidridima, u kojima je –I; 3) oksidacijski broj kisika uvijek je –II, osim u peroksidima, u kojima je –I, a samo je u spoju s fluorom I; 4) oksidacijski broj svih jednoatomnih iona (gradivne čestice ionskih spojeva) jednak je naboju iona, npr. oksidacijski broj kalcija u ionu Ca2+ je II, a klora u kloridnom ionu Cl– je –I; 5) zbroj oksidacijskih brojeva svih atoma u neutralnoj molekuli ili formulskoj jedinki mora biti jednak nuli; 6) zbroj oksidacijskih brojeva atoma u višeatomnim ionima mora biti jednak naboju iona 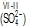 ; 7) u kovalentnim spojevima oksidacijski broj nekog atoma jednak je zamišljenomu naboju koji ostaje na tom atomu kada se zajednički elektronski parovi dodijele elektronegativnijem atomu (
; 7) u kovalentnim spojevima oksidacijski broj nekog atoma jednak je zamišljenomu naboju koji ostaje na tom atomu kada se zajednički elektronski parovi dodijele elektronegativnijem atomu (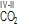 ); 8) oksidacijski broj fluora (najelektronegativniji element) uvijek je –I; 9) oksidacijski broj alkalijskih elemenata uvijek je I, a zemnoalkalijskih II. Poznavanje oksidacijskoga broja nužno je pri rješavanju kemijskih jednadžbi koje opisuju redoks-reakcije.
); 8) oksidacijski broj fluora (najelektronegativniji element) uvijek je –I; 9) oksidacijski broj alkalijskih elemenata uvijek je I, a zemnoalkalijskih II. Poznavanje oksidacijskoga broja nužno je pri rješavanju kemijskih jednadžbi koje opisuju redoks-reakcije.